NGS精准指导:ALK V1180L伴SCLC转化双重耐药,洛拉替尼治疗获益

导语
从非小细胞肺癌(NSCLC)到小细胞肺癌(SCLC)的组织学转化是EGFR突变型NSCLC使用EGFR-TKI治疗时的常见耐药机制,发生率约为4-14%。相对而言,ALK-TKI耐药后发生SCLC转化的现象要少得多。迄今为止,文献中似乎只有11篇关于ALK-TKI耐药后发生SCLC转化的病例报道,见表1。大多数情况下,患者在发生SCLC转化后,靶向治疗或化疗的效果有限,疾病会快速进展。

表1. 关于ALK-TKI耐药后发生SCLC转化的病例报告汇总
近日,安徽省胸科医院徐宁教授团队和徐玲玲教授团队合作,首次报道了一个病例:一例ALK阳性NSCLC患者,在接受阿来替尼治疗耐药后,组织学发生SCLC转化,使用NGS检出ALK V1180L获得性突变,患者经EP方案化疗无效后,经洛拉替尼治疗获得疾病缓解。该病例为ALK阳性SCLC转化患者的靶向治疗提供了参考。相关研究成果已发表于Lung Cancer(IF=5.3)。
病例详情
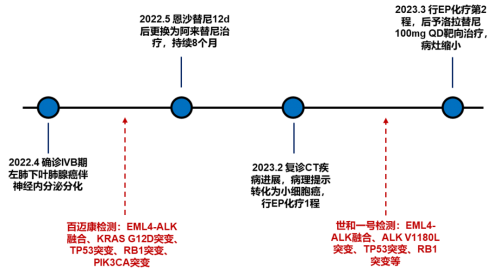
2022年4月首次确诊,基因检测发现EML4-ALK融合,予阿来替尼治疗
患者基本信息:男性,52岁,因“咳嗽3月余“入院就诊。
胸部CT(2022-3-24):左肺下叶占位,考虑肺癌伴纵隔及左肺门淋巴结转移,双肺结节,心包腔积液。
经皮肺穿刺活检(2022-4-2):组织学形态结合免疫组化结果CK5/6(-)、CK7(+)、CK(+)、Ki-67(约50%+)、P40(-)、TTF-1(+)、Napsin-A(-)、Syn(+)、CD56(+)、CgA(-)、ALK(D5F3)(+),符合浸润性低分化癌,倾向为浸润性腺癌伴神经内分泌分化。
临床诊断:左肺下叶肺腺癌伴神经内分泌分化,IVB期(cT3N2M1),伴多发骨转移及脑转移。
PD-L1免疫组化检测(2022-4-5):PD-L1表达阴性(TPS<1%)。
基因检测(2022-4-5):组织送检NGS发现EML4-ALK融合(V3型,丰度28.6%)、KRAS G12D突变、TP53突变、RB1突变、PIK3CA突变。患者未行进一步治疗。
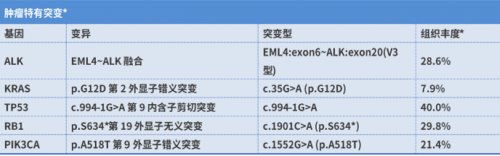
图1. NGS检测结果提示EML4-ALK融合
治疗经过(2022-5-9):口服恩沙替尼12d后转院就诊,因医保原因于2022-5-21更换为阿来替尼继续治疗,未见明显不适。1月后复查肺部、颅内病灶明显缩小,疗效评价PR,后多次复查评估肿瘤稳定。
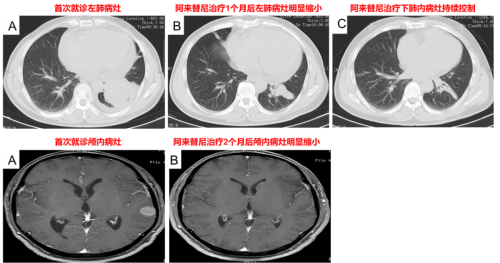
图2. 阿来替尼治疗后复查肺部及颅内病灶明显缩小
2023年2月复诊CT疾病进展,发生SCLC组织学转化,基因检测提示ALK V1180L继发耐药突变,予洛拉替尼治疗,病灶缩小
复查结果(2023-2-1):复查胸部CT示肺部病灶进展,头颅MRI示颅内病灶进展。
气管镜检查(2023-2-6):组织学形态结合免疫组化结果肿瘤细胞CK (核旁点灶状+)、TTF-1(+)、Syn(+)、CD56(+)、Ki-67(约90%+)、CD3( -)、CD20(-) 提示转化为小细胞癌。
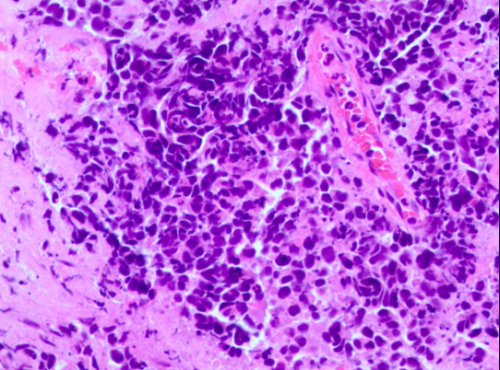
图3. 气管镜活检病理结果提示小细胞癌转化
治疗经过(2023-2-9):停服阿来替尼,行依托泊苷+顺铂(EP)化疗1程,有2级消化道反应。
基因检测(2023-2-14):组织送检NGS发现EML4-ALK融合(V3型,丰度46.33%)、ALK V1180L突变、TP53突变、RB1突变等,TMB 11.3 muts/Mb,MSS型。
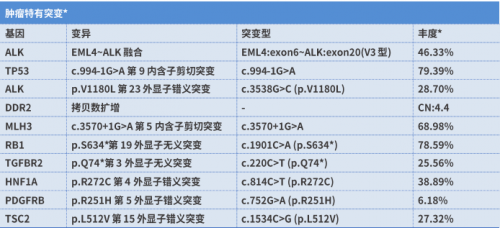

图4. NGS检测结果提示ALK V1180L继发耐药突变
治疗经过(2023-3-3):2023-3-3复查左肺病灶与前相仿。2023-3-6行EP化疗第2程,左胸部出现不适感。2023-3-14开始洛拉替尼100mg QD靶向治疗,3日后出现发热、腹泻不适,发热最高体温38.9℃,腹泻每日2-3次水样便。2023-3-20就诊,考虑上呼吸道感染、消化道反应,继续洛拉替尼治疗,复查CT示左肺不张较老片加重,伴有左侧胸腔积液,对症处理后发热、腹泻改善。2023-4-14胸部CT示左肺病灶缩小、左侧胸腔积液减少,随后头颅MRI示颅内病灶缩小。2023-5-12胸部CT示左肺病灶继续缩小,伴有1级双下肢浮肿,生活质量明显改善。
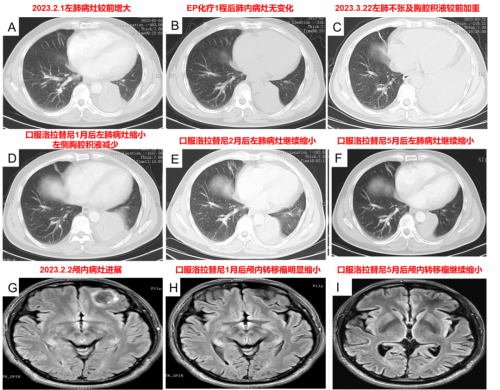
图5. 洛拉替尼治疗后复查肺部及颅内病灶明显缩小
患者诊疗流程总结
结语
本研究验证了洛拉替尼对携带ALK V1180L突变的ALK阳性SCLC转化患者的治疗效果,并进一步强调了ALK-TKI耐药后重新评估患者基因突变的重要性。此外,该案例还提示我们,如果在ALK-TKI耐药后发生SCLC转化的患者中发现驱动突变,靶向治疗可能仍然有效。
本研究使用了世和基因百迈康®Panel。
参考文献
[1] Antonescu CR, Dickson BC, Swanson D et al. Spindle cell tumors with RET gene fusions exhibit a morphologic spectrum akin to tumors with NTRK gene fusions. Am. J. Surg. Pathol. 2019; 43; 1384–1391
[2] Davis JL, Vargas SO, Rudzinski ER et al. Recurrent RET gene fusions in paediatric spindle mesenchymal neoplasms. Histopathology 2020; 76; 1032–1041
[3] Panet F, Jung S, Alcindor T. Sustained response to the mitogen-activated extracellular kinase inhibitor Trametinib in a spindle cell sarcoma harboring a QKI-RAF1 gene fusion. JCO Precis. Oncol. 2022; 6; e2100303.
[4] Michal M, Ptakov a N, Mart ınek P et al. S100 and CD34 posi tive spindle cell tumor with prominent perivascular hyalinisa tion and a novel NCOA4-RET fusion. Genes Chromosomes Cancer 2019; 58; 680–685.
[5] Weisman PS, Altinok M, Carballo EV et al. Uterine cervical sar coma with a novel RET-SPECC1L fusion in an adult: a case which expands the homology between RET-rearranged and NTRK rearranged tumors. Am. J. Surg. Pathol. 2020; 44; 567–570
[6] Zhao M, Yin X, He H, Xia Q, Ru G. Recurrent RET fusions in fibrosarcoma-like neoplasms in adult viscera: expanding the clinicopathological and genetic spectrum. Histopathology. 2022 Nov 28. doi: 10.1111/his.14847. Epub ahead of print. PMID: 36443894.
