【IF 9.9】多中心vs壁内转移:NGS描绘多灶食管鳞癌分子特征
【IF 9.9】多中心vs壁内转移:NGS描绘多灶食管鳞癌分子特征

导读
多灶食管鳞状细胞癌(ESCCs)可能是多中心来源(MO)或壁内转移(IMM)。MO起源于独立的肿瘤克隆,通常在ESCC的早期发现;而IMM的原发肿瘤通过管壁内的淋巴管网转移至其它部位,是预后不良的标志。然而,组织病理上对于ESCC中MO和IMM的准确区分存在挑战,基于分子层面的探索,或许可以为MO和IMM的鉴别诊断提供更多信息。
中国医学科学院肿瘤医院病理科薛丽燕教授、李卫华教授团队,对多灶ESCC进行NGS检测和分析,全面探究了多灶ESCC的异质性、克隆关系和免疫微环境,为区分MO和IMM提供助力。相关研究成果已发表在Journal of Pathology(IF=9.883)。
研究亮点
1、揭示了MO和IMM肿瘤区域间的克隆演化差异,为准确辨别MO和IMM提供助力;
2、单独的免疫组化不足以准确区分IMM和MO,分子特征可提供更为全面的鉴别信息;
3、MO和IMM具有不同的免疫微环境特征。
研究设计
本研究回顾性分析了2009年1月至2018年12月期间,在中国医学科学院肿瘤医院接受手术治疗的5224例ESCC,其中333例(6.4%)为多灶ESCC。这333例中有188例可以通过组织学明确分类为MO(n=109)或IMM(n=79)。从剩下的145例未能通过组织学分类的患者中,纳入14例作进一步分子分析,纳入标准:1、所有患者均为同时性多灶ESCC;2、术前均未接受化疗、放疗或免疫治疗;3、两肿瘤间粘膜上皮大部分形态正常。
这14例多灶ESCC(P1-P14)均有2到3个独立的肿瘤(T1、T2、T3),每个独立的肿瘤均取两个区域(Ta、Tb)进行WES测序。此外,再取对应的正常食道组织样本,以及11例存在淋巴结转移患者的淋巴结样本(LN)进行WES测序。
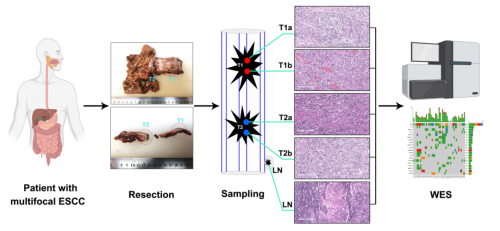
图1. 多灶食管鳞状细胞癌WES测序采样图示
研究结果
ESCC肿瘤区域间的体细胞突变共享情况可以帮助辨别MO和IMM
比较同一患者不同肿瘤区域的非同义体细胞突变,将突变分为trunk(在所有肿瘤中都有的突变)、T-shared(T1、T2、T3共有突变)、TLN-shared(T1、T2或T3与LN共有突变)、internal branch(Ta和Tb共有突变)和私有突变。在每个肿瘤中观察到不同程度的私有突变(25-90%),这意味着ESCC瘤内异质性较高。根据trunk和T-shared突变的比例,14例患者(P1-P14)可分为3组:无trunk和T-shared突变的MO组(P5、P8、P12),MO和IMM混合的MIX组(P3),以及trunk或T-shared突变率高的IMM组(其他患者)(图2C)。
在不同患者之间未观察到共有突变,这表明在不同独立的肿瘤克隆之间很少发生重叠的体细胞突变。为了证实通过突变分析对多灶ESCC进行分类的可行性,本研究对5例经组织学证实的IMM肿瘤进行测序,5例IMM患者的所有肿瘤至少有两个共有突变,这意味着多灶ESCC肿瘤间的共同突变是IMM的有力指标。
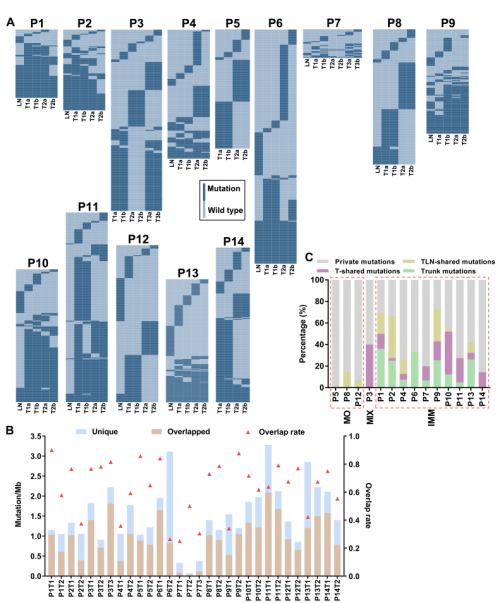
图2. 14例多灶ESCC的体细胞突变情况
ESCC的克隆关系和基因组异质性帮助认识肿瘤发生和转移过程
为了进一步研究多灶ESCC的克隆相关性和基因组异质性,本研究基于每个患者的体细胞突变构建了分子进化树。在MO(P5、P8和P12)和MIX(P3)患者中未观察到trunk突变,这意味着多个独立的肿瘤。在IMM中,每个患者的trunk基因比例不同,TP53和NOTCH1是肿瘤中最常见的共同突变基因。有趣的是,在P1、P6、P10和P13中,LN肿瘤与T1和T2肿瘤具有不同的遗传景观,这意味着在T1和T2肿瘤分化之前就可能发生LN转移。而在P4和P9中,LN肿瘤只与一个肿瘤出现了高比例的共享突变,这意味着来自原发肿瘤的癌细胞可能首先形成IMM,而LN转移瘤则直接来源于原发肿瘤或IMM。此外,P8、P10、P11和P12病例似乎有早期淋巴结累及,因为他们的LN与T1、T2肿瘤共有突变较少,而P1、P2、P6和P9病例的淋巴结转移可能发生较晚,因为共有的变异较多。

图3. 14例多灶ESCC的分子进化树
Jaccard相似性系数显示,每个MO患者肿瘤之间的相似性极低,而IMM组中,同一患者的不同肿瘤之间高度相似。与MO相比,IMM病灶体细胞拷贝数改变(SCNAs)共享率更高。IMM组和MO组在突变谱和突变特征上无显著差异(图4B、C)。
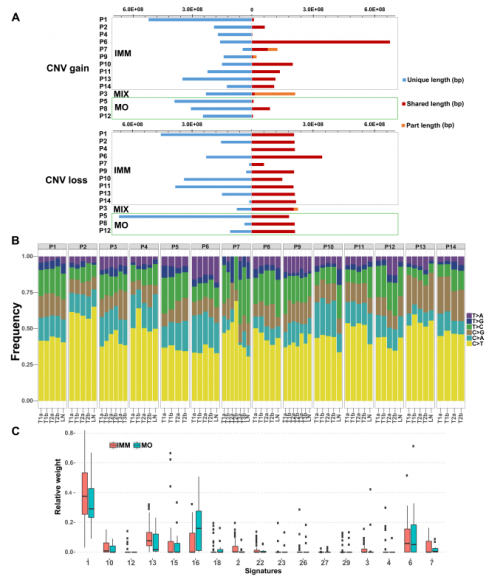
图4. 多病灶患者的局灶性体细胞拷贝数改变(SCNAs)、突变谱和特征的贡献
TP53是ESCC的常见突变基因,单纯p53 IHC不足以准确区分IMM和MO
在IMM中,同一患者的不同肿瘤之间有1到7个共有突变,而在MO中未发现共有突变。TP53是最常见的突变基因(67%)(图5A)。通过免疫组化进一步检测p53表达发现,P5和P8(MO)的T1和T2肿瘤间p53免疫染色情况完全不同(图5B)。P3(MIX)的T1和T3肿瘤具有TP53错义突变(p. I100S),显示p53的弥漫和强表达,证实了这两个肿瘤的单克隆起源;而T2肿瘤中含有TP53移码缺失突变(p.L6fs),显示p53表达完全丧失,这意味着T2和T1/T3肿瘤之间的独立起源。在P12(MO)病例中,T1和T2肿瘤均显示p53表达完全缺失,尽管在T2肿瘤中检测到TP53剪接突变(c.673-1G>A),但在T1肿瘤中未检测到TP53突变,这表明p53的IHC不足以准确区分IMM和MO。
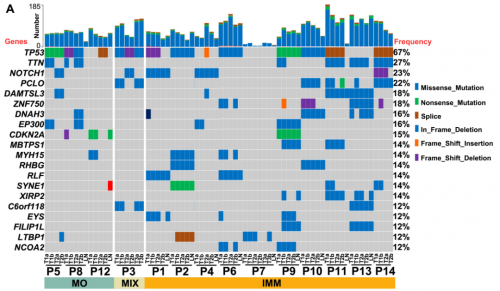
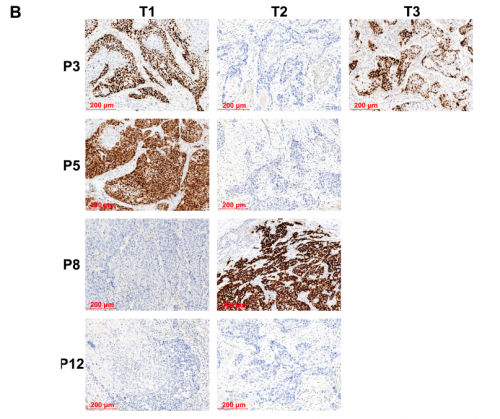
图5. 多灶ESCC中显著突变基因(SMGs)和p53表达
MO和IMM具有不同的免疫微环境
为了进一步探索其免疫特性,研究者分析了14例多灶ESCC中60个肿瘤区域的750个免疫相关基因表达。结果显示,在所有MO和MIX病例中,来自同一肿瘤的两个不同区域展现了相似的免疫相关基因表达谱,而这仅发生于30%(3/10)的IMM病例,进一步证实了多灶ESCC的克隆关系。
研究者进一步基于免疫细胞标志物的表达对肿瘤免疫微环境进行了表征。MO中肿瘤大小和免疫细胞水平呈现了一定的相关性:较大肿瘤(T1)中CD45+细胞、B细胞、肥大细胞、CD8+T细胞、耗竭CD8+T细胞和总T细胞的水平高于较小肿瘤(T2/T3)(图6A)。同时,RNA和蛋白分析均显示,大肿瘤(T1)中PD-L1 (CD274)和CD8(CD8A)的表达高于小肿瘤(T2/T3)(图6B)。此外,免疫和增殖通路在大肿瘤(T1)中比小肿瘤(T2/T3)中更活跃。然而,在IMM中,小肿瘤和大肿瘤之间的免疫细胞浸润和PD-L1表达没有显著差异(图6C、D)。最后,研究者比较了MO和IMM肿瘤,发现它们富集的信号通路没有显著差异。另一方面,MO组的CD45+细胞、耗竭CD8+ T细胞、肥大细胞、总T细胞和Treg细胞水平明显高于IMM组,这意味着两种类型的多灶ESCC具有不同的肿瘤免疫微环境。
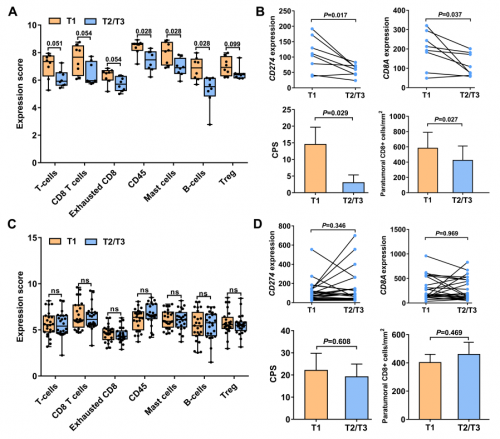
图6. 多灶ESCC患者不同病灶的免疫异质性
结语
本研究全面描述了多灶ESCC基因变异和免疫微环境的克隆关系和异质性,可能为区分MO和IMM提供诊断依据,并为多灶ESCC患者不同肿瘤间免疫治疗反应的潜力提供治疗指征。
本研究使用了世和基因全外显子测序(WES)技术。
参考文献
Li W, Cheng N, Zhao Z, Zheng B, Yang Z, Xu Y, Shao Y, Song Y, Lu N, Xue L. Molecular characteristics of multifocal esophageal squamous cell carcinomas to discriminate multicentric origin from intramural metastasis. J Pathol. 2022 Dec;258(4):395-407. doi: 10.1002/path.6010. Epub 2022 Oct 21. PMID: 36098222.
